Das Fibromyalgie-Syndrom (FMS) ist jetzt zwar als eigenständiges Krankheitsbild anerkannt, die ihm zugrunde liegende pathophysiologischen Mechanismen sind allerdings immer noch rätselhaft.
Beim FMS handelt es sich um ein chronisches Leiden mit verstärkter Schmerzempfindlichkeit, erhöhten Sensibilität gegenüber mechanischen Belastungen und Kälte, sowie chronische Müdigkeit und emotionalen Stress.
Die Prävalenz des FMS beträgt ca. 2% und zeigt einen 80%igen Überhang von Frauen. Bei Patientinnen mit primären Autoimmunerkrankungen, v.a. solchen aus dem rheumatischen Formenkreis, steigt die Prävalenz bis auf 10-30% an. In diesen Fällen ist das zusätzliche FMS eine wesentliche Ursache für die chronischen Schmerzen.
Da, wie erwähnt, die pathophysiologischen Grundlagen für die Entwicklung der Erkrankung nicht geklärt sind, sind auch bisher keine spezifischen diagnostischen Tests für ein FMS verfügbar Ach therapeutisch existieren nur symptomatische Möglichkeiten wie Änderung des Lebensstils, Bewegung, sowie Behandlungen mit entzündungshemmenden, antidepressiven und krampflösenden Medikamenten. Da die Wirkung dieser Therapien äusserst unbefriedigend ist, besteht diesbezüglich grosser Handlungsbedarf.
Wegen der Tatsache, dass Patienten mit Autoimmunerkrankungen besonders anfällig für die zusätzliche Belastung mit einem FMS sind, wurde schon lange die Möglichkeit diskutiert, dass es ich hier ebenfalls um eine Autoimmunerkrankung sui genesis handeln könnte.
Nun gibt es erstmals aufregende und aussagekräftige Daten, die diese Hypothese untermauern.
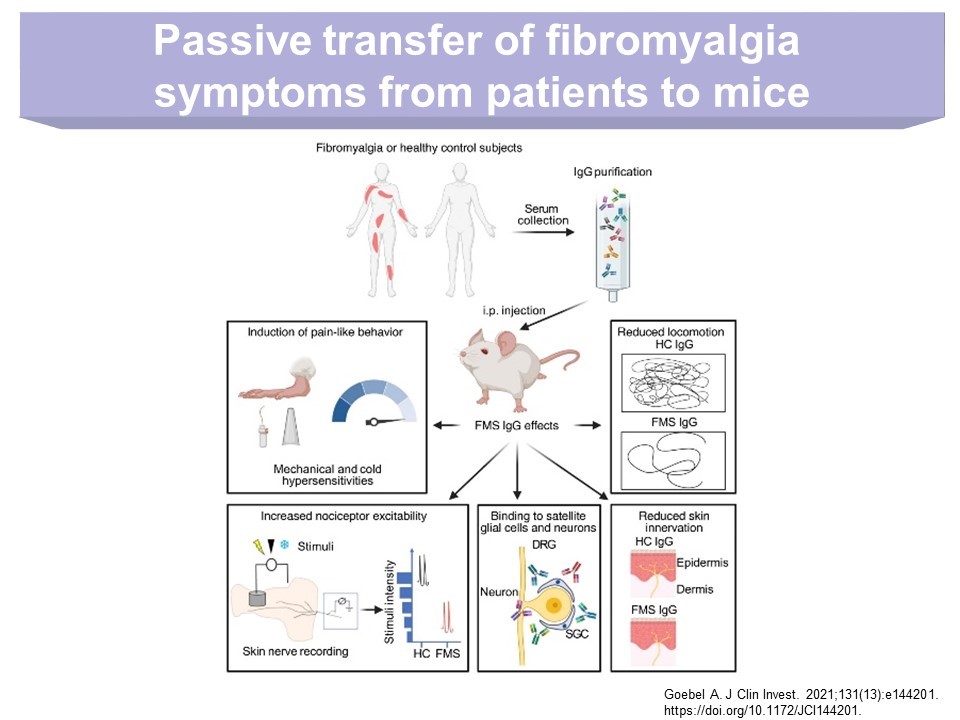
In einer Arbeit von Andreas Goebel et. al. (Ref., Abb1.) wird gezeigt, dass die intraperitoneale (i.p) Injektion von gereinigtem IgG aus dem Serum von FMS Patienten in weibliche Mäuse des Stammes C57BL/6 zu FMS-ähnlichen Symptomen führt. Die Tiere entwickeln eine sensible Überempfindlichkeit durch Stimulation von nozizeptiven Neuronen. Wie PatientInnen mit FMS zeigten diese Mäuse auch eine starke Empfindsamkeit gegenüber mechanischen und Kältereizen, bedingt durch eine erhöhte Reaktion von nozizeptiven Fasern in der Haut auf diese Formen von lokalem Stress. Die Tiere bewegen sich weniger als Kontrollen, deren gereinigtes IgG von gesunden Spendern verabreicht worden war. Sie zeigten ausserdem eine verminderte Griffstärke und einen Verlust intradermaler Nervenfasern. Wenn IgG aus dem Patientenserum entfernt wurde, kam es bei den Versuchstieren zu keinen derartigen Symptomen; sie verhielten sich wie jene, denen IgG von Gesunden injiziert wurde.
IgG von Patienten aktivieren naive, sensible Neuronen nicht direkt, sondern binden sich in vitro und in vivo sowohl an Satelliten-Gliazellen als zu einem geringeren Grad auch an Makrophagen und Endothelzellen in den dorsalen Wurzelganglien (dorsal root ganglia – DRG), aber nicht an Zellen im Rückenmark. Mittels auf gleiche Weise durchgeführten Immunfluoreszenztests konnten die Autoren nachweisen, dass sich FMS-IgG auch in humanen DRG ablagert.
Zusammenfassend zeigen diese Daten also erstmals, dass IgG von FMS-Patienten in Versuchstieren schmerzhafte sensorische Überempfindlichkeitsreaktionen hervorrufen, indem sie periphere, nozizeptive, afferente Nervenfasern sensibilisieren. Die Autoren diskutieren daher, dass eine Entfernung von IgG aus dem Patientenserum durch eine Plasmapherese – später ev. rekombinant mit einer antigenspezifischen Immunadsorption – eine effektive Therapie für FMS sein könnte.
Jetzt sollte also möglichst rasch abgeklärt werden mit welchen/m (Auto)-Antigen/en die IgG Antikörper im Serum von FMS-Patienten reagieren. Die immunologischen Methoden zur Klärung dieser Frage – von Phage Display bis zu neuesten proteomischen Techniken – sind vorhanden, und es wird sicher nicht lange dauern, bis dieses Problem gelöst ist.
Referenz:
Goebel, A., et. al. (2021). Passive transfer of fibromyalgia symptoms from patients to mice. Journal of Clinical Investigation, 131(13). https://doi.org/10.1172/jci144201
Abb1.: